Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
152 View


Lý thuyết về tính chất của crom, sắt và hợp chất
A. CROM VÀ HỢP CHẤT CỦA CROM
I. Tính chất vật lý, cấu tạo
- Crom có màu trắng ánh bạc, rất cứng (cứng nhất trong số các kim loại), khó nóng chảy (1890oC). - Crom là kim loại nặng, có khối lượng riêng 7,2 g/cm3. - Crom có số hiệu nguyên tử là 24, thuộc nhóm VIB, chu kì 4. - Có các số oxi hóa là +2, +3, +6.II. Tính chất hóa học
1. Crom - Tác dụng với phi kim - Bền với nước và không khí do có màng oxit vững chắc bảo vệ.
- Tác dụng với axit:
+ Khi tác dụng với dung dịch HCl, H2SO4 loãng tạo ra muối Cr (II).
Cr + 2HCl → CrCl2 + H2
+ Cr không phản ứng với HNO3 và H2SO4 đặc nguội.
Chú ý: Crom không tan được trong dung dịch NaOH loãng cũng như dung dịch NaOH đặc nóng.
2. Một số hợp chất của Crom
- Cr2O3: là những oxit lưỡng tính, tan được trong dung dịch axit và kiềm đặc.
- Cr(OH)3 là hiđroxit lưỡng tính, được điều chế từ muối Crom (III) và dung dịch kiềm.
- CrO3: là một oxit có tính axit, có tính oxi hóa rất mạnh.
- Muối cromat và đicromat: đều có tính oxi hóa mạnh
+ Trong môi trường axit, cromat chuyển hóa thành đicromat.
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
+ Trong môi trường kiềm đicromat chuyển hóa thành cromat.
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
- Bền với nước và không khí do có màng oxit vững chắc bảo vệ.
- Tác dụng với axit:
+ Khi tác dụng với dung dịch HCl, H2SO4 loãng tạo ra muối Cr (II).
Cr + 2HCl → CrCl2 + H2
+ Cr không phản ứng với HNO3 và H2SO4 đặc nguội.
Chú ý: Crom không tan được trong dung dịch NaOH loãng cũng như dung dịch NaOH đặc nóng.
2. Một số hợp chất của Crom
- Cr2O3: là những oxit lưỡng tính, tan được trong dung dịch axit và kiềm đặc.
- Cr(OH)3 là hiđroxit lưỡng tính, được điều chế từ muối Crom (III) và dung dịch kiềm.
- CrO3: là một oxit có tính axit, có tính oxi hóa rất mạnh.
- Muối cromat và đicromat: đều có tính oxi hóa mạnh
+ Trong môi trường axit, cromat chuyển hóa thành đicromat.
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
+ Trong môi trường kiềm đicromat chuyển hóa thành cromat.
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
B. SẮT VÀ HỢP CHẤT CỦA SẮT
I. Tính chất vật lý, cấu tạo
- Sắt có Z = 26 thuộc nhóm VIIIB, chu kì 4 của bảng tuần hoàn. - Cấu hình electron của Fe: [Ar]3d64s2; Fe2+: [Ar]3d6; Fe3+: [Ar]3d5. - Số oxi hóa: +2, +3. - Có màu trắng, hơi xám, dẻo, dễ rèn, nóng chảy ở nhiệt độ 1540oC, D = 7,9 g/cm3, dẫn điện, dẫn nhiệt tốt, có tính nhiễm từ.II. Tính chất hóa học
1. Sắt Tính khử trung bình (tác dụng với oxi, lưu huỳnh, clo, nước, dung dịch axit, dung dịch muối). + Với chất oxi hóa yếu: Fe → Fe2+ + 2e. + Với chất oxi hóa mạnh: Fe → Fe3+ + 3e. + Fe thụ động với H2SO4 và HNO3 đặc nguội. Một số phương trình minh họa 2. Hợp kim của sắt
a. Gang
- Gang là hợp kim của sắt với cacbon, trong đó C chiếm 2 – 5% về khối lượng.
- Phân loại: Gang trắng và gang xám.
- Nguyên tắc luyện gang: khử oxit sắt trong quặng thành sắt.
- Các phương trình hóa học:
Tạo chất khử: C + O2 → CO2 và C + CO2 → 2CO.
Quá trình khử: Fe2O3 → Fe3O4 → FeO → Fe.
Loại tạp chất trong quặng:
CaCO3 → CaO + CO2
CaO + SiO2 → CaSiO3
b. Thép
- Là hợp kim của sắt với C trong đó C chiếm 0,01 – 2% về khối lượng.
- Phân loại: thép thường và thép đặc biệt.
- Nguyên tắc luyện gang thành thép: loại bỏ phần lớn các nguyên tố C, Si, Mn, S, … ra khỏi gang bằng cách oxi hóa chúng và chuyển thành xỉ.
- Các phương trình hóa học:
C + O2 → CO2;
S + O2 → SO2;
Si + O2 → SiO2;
4P + 5O2 → 2P2O5 (xỉ);
CaO + SiO2 → CaSiO3;
3CaO + P2O5 → Ca3(PO4)3 (xỉ).
- Phương pháp luyện thép: phương pháp Bet-xơ-me (lò thổi oxi); phương pháp Mac-tanh (lò bằng); phương pháp lò điện.
- Gang và thép được sử dụng rất phổ biến trong các ngành công nghiệp và đời sống.
2. Hợp kim của sắt
a. Gang
- Gang là hợp kim của sắt với cacbon, trong đó C chiếm 2 – 5% về khối lượng.
- Phân loại: Gang trắng và gang xám.
- Nguyên tắc luyện gang: khử oxit sắt trong quặng thành sắt.
- Các phương trình hóa học:
Tạo chất khử: C + O2 → CO2 và C + CO2 → 2CO.
Quá trình khử: Fe2O3 → Fe3O4 → FeO → Fe.
Loại tạp chất trong quặng:
CaCO3 → CaO + CO2
CaO + SiO2 → CaSiO3
b. Thép
- Là hợp kim của sắt với C trong đó C chiếm 0,01 – 2% về khối lượng.
- Phân loại: thép thường và thép đặc biệt.
- Nguyên tắc luyện gang thành thép: loại bỏ phần lớn các nguyên tố C, Si, Mn, S, … ra khỏi gang bằng cách oxi hóa chúng và chuyển thành xỉ.
- Các phương trình hóa học:
C + O2 → CO2;
S + O2 → SO2;
Si + O2 → SiO2;
4P + 5O2 → 2P2O5 (xỉ);
CaO + SiO2 → CaSiO3;
3CaO + P2O5 → Ca3(PO4)3 (xỉ).
- Phương pháp luyện thép: phương pháp Bet-xơ-me (lò thổi oxi); phương pháp Mac-tanh (lò bằng); phương pháp lò điện.
- Gang và thép được sử dụng rất phổ biến trong các ngành công nghiệp và đời sống.
Bài 1 (trang 165 SGK Hóa 12):
Điền công thức hóa học của chất vào những chỗ trống và lập các phương trình hóa học sau: a. Fe + H2SO4đặc → SO2 + ……… b. Fe + HNO3đặc → NO2 + ……… c. Fe + HNO3loãng → NO + ……… d. FeS + HNO3 → NO + Fe2(SO4)3 + ……… Lời giải: 2Fe + 6H2SO4(d) → 3SO2 + Fe2(SO4)3 + 6H2O Fe + 6HNO3(d) → 3NO2 + Fe(NO3)3 + 3H2O Fe + 4HNO3(l) → NO + Fe(NO3)3 + 2H2O 3FeS + 12HNO3 → 9NO + Fe2(SO4)3 + Fe(NO3)3 + 6H2OBài 2 (trang 165 SGK Hóa 12):
Bằng phương pháp hóa học, hãy phân biệt 3 mẫu hợp kim sau: Al – Fe; Al – Cu ; Cu – Fe. Lời giải: Cho dung dịch NaOH vào 3 mẫu hợp kim, mẫu thử nào có khí thoát ra là Al-Fe và Al-Cu, mẫu thử nào không có khí thoát ra là Cu-Fe 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 Cho dung dịch HCl đến dư vào hai mẫu thử trên, mẫu thử nào không hòa tan hết là Al-Cu, mẫu thử nào tan hết là Al-Fe 2Al + 6HCl → 2AlCl3 + 3H2 Fe + 2HCl → FeCl2 + H2Bài 3 (trang 165 SGK Hóa 12):
Một hỗn hợp bột gồm Al, Fe, Cu, Hãy trình bày một phương pháp hóa học để tách từng kim loại ra khỏi hỗn hợp đó. Viết các phương trình hóa học của các phản ứng. Lời giải: Cho dung dịch NaOH dư vào hỗn hợp 3 kim loại thu được hai phần. - Phần dung dịch là NaAlO2 và NaOH dư - Phần chất rắn là Cu và Fe Al + NaOH + H2O → NaAlO2 +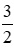 H2
Lấy phần dung dịch dẫn CO2 đến dư thu được kết tủa Al(OH)3. Lọc lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi thu được chất rắn là Al2O3. Điện phân nóng chảy Al2O3 ta được Al.
NaAlO2 + CO2 + H2O → NaHCO3 + Al(OH)3 ↓
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
2Al(OH)3 → Al2O3 + 3H2O
2Al2O3 → 4Al + 3O2
Phần chất rắn đem hòa tan trong HCl dư, thu được dung dịch là FeCl2, còn phần chất rắn là Cu. Điện phân dung dịch thu được ta được Fe.
Fe + 2HCl → FeCl2 + H2
FeCl2 → Fe + Cl2
H2
Lấy phần dung dịch dẫn CO2 đến dư thu được kết tủa Al(OH)3. Lọc lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi thu được chất rắn là Al2O3. Điện phân nóng chảy Al2O3 ta được Al.
NaAlO2 + CO2 + H2O → NaHCO3 + Al(OH)3 ↓
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
2Al(OH)3 → Al2O3 + 3H2O
2Al2O3 → 4Al + 3O2
Phần chất rắn đem hòa tan trong HCl dư, thu được dung dịch là FeCl2, còn phần chất rắn là Cu. Điện phân dung dịch thu được ta được Fe.
Fe + 2HCl → FeCl2 + H2
FeCl2 → Fe + Cl2
Bài 4 (trang 165 SGK Hóa 12):
Cho một ít bột sắt nguyên chất tác dụng hết với dung dịch H2SO4 loãng thu được 560 ml một chất khí ở đktc. Nếu cho một lượng gấp đôi bột sắt nói trên tác dụng hết với dung dịch CuSO4 thì thu được một chất rắn. Tính khối lượng bột sắt đã dùng trong hai trường hợp nói trên và khối lượng chất rắn thu được. Lời giải: Số mol H2 làBài 5 (trang 165 SGK Hóa 12):
Biết 2,3 gam hỗn hợp gồm MgO, CuO, FeO tác dụng vừa đủ với 100ml dung dịch H2SO4 0,2M. Khối lượng muối thu được là : A. 3,6 gam. B. 3,7 gam. C. 3,8 gam. D. 3,9 gam. Lời giải: Đáp án D. nH2SO4 = 0,1. 0,2 = 0,02 mol RO + H2SO4 → RSO4 + H2O 1 mol oxit (RO) → 1 mol muối sunfat (RSO4) ⇒ khối lượng tăng là: 96 – 16 = 80g Khối lượng muối thu được là: 2,3 + 80. 0,02 = 3,9 g nH2SO4 = 0,2.0,1 = 0,02 mol 2,3g (MgO, CuO, FeO) + 0,2 mol H2SO4 → muối sunfat + H2O Ta thấy: nH2SO4 = nH2O = 0,2 mol Áp dụng DLBTKL: moxit + mH2SO4 = mmuối + mH2O ↔ 2,3 + 96.0,2 = mmuối + 18.0,2 ↔ mmuối = 3,9 (g)Bài 6 (trang 165 SGK Hóa 12):
Nguyên tử của nguyên tố X có tổng số hạt cơ bản (p,n,e) là 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. Nguyên tố X là nguyên tố nào? A. Sắt. B. Brom. C. Photpho. D. Crom. Lời giải: Đáp án A. Gọi p, n, e lần lượt là số proton, notron và electron. Ta có p + n + e = 82. p + e - n = 22. Mà p = e → 2p + n =82 2p – n = 22 → p = e = 26 ; n = 30. X là Fe.Chương 1: Este - Lipit
Chương 3: Amin, amino axit và protein
Chương 5: Đại cương về kim loại
- Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
- Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại
- Bài 19: Hợp kim
- Bài 20: Sự ăn mòn kim loại
- Bài 21: Điều chế kim loại
- Bài 22: Luyện tập: Tính chất của kim loại
- Bài 23: Luyện tâp: Điều chế kim loại và sự ăn mòn kim loại
- Bài 24: Thực hành: Tính chất, điều chế kim loại, sự ăn mòn kim loại
Chương 6: Kim loại kiềm, kim loại kiềm thổ, nhôm
- Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
- Bài 26: Kim loại kiềm thổ
- Bài 27: Nhôm và hợp chất của nhôm
- Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
- Bài 29: Luyện tập: Tính chất của nhôm và hợp chất của nhôm
- Bài 30: Thực hành: Tính chất của natri, magie, nhôm và hợp chất của chúng
Chương 7: Sắt và một số kim loại quan trọng
- Bài 31: Sắt
- Bài 32: Hợp chất của sắt
- Bài 33: Hợp kim của sắt
- Bài 34: Crom và hợp chất của crom
- Bài 35: Đồng và hợp chất của đồng
- Bài 36: Sơ lược về niken, kẽm, chì, thiếc
- Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
- Bài 38: Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng
- Bài 39: Thực hành: Tính chất hóa học của sắt, đồng và nhưng hợp chất của sắt, crom
Chương 8: Phân biệt một số chất vô cơ
- Bài 40: Nhận biết một số ion trong dung dịch
- Bài 41: Nhận biết một số chất khí
- Bài 42: Luyện tập: Nhận biết một số chất vô cơ
Chương 9: Hóa học và vấn đề phát triển kinh tế, xã hội, môi trường
Các bài viết liên quan
Các bài viết được xem nhiều nhất
5 tác phẩm trọng tâm ôn thi THPT Quốc gia 2024 môn Ngữ Văn khả năng...
26236 View
Đáp án CHÍNH THỨC đề thi tốt nghiệp THPT 2023 từ Bộ GD&ĐT (Tất cả...
1166 View
Đề thi tốt nghiệp THPT Quốc gia năm 2023 môn Địa lí và gợi ý giải...
1092 View
Đề thi tốt nghiệp THPT Quốc gia năm 2023 môn Giáo dục công dân và gợi...
1080 View
Link tra cứu điểm thi THPT Quốc gia 2023 toàn quốc 63 tỉnh thành. Cách xem...
999 View
Theo dõi Captoc trên




