Bài 5: Glucozơ
103 View


Tính chất của Glucozo
I. Tính chất vật lý và trạng thái tự nhiên
- Glucozơ là chất kết tinh, không màu, nóng chảy ở 146oC (dạng α) và 150oC (dạng β). - Dễ tan trong nước. - Có vị ngọt nhưng không ngọt bằng đường mía, Glucozơ có trong hầu hết các bộ phận của cây như lá, hoa, rễ, ... và nhất là trong quả chín. - Trong máu người có một lượng nhỏ glucozơ, hầu như không đổi (khoảng 0,1 %).II. Cấu trúc phân tử
Glucozơ có công thức phân tử là C6H12O6, tồn tại ở dạng mạch hở và mạch vòng. 1. Dạng mạch hở
Bằng thực nghiệm cho thấy:
- Khử hoàn toàn glucozơ thì thu được hexan. Vậy 6 nguyên tử C của phân tử glucozơ tạo thành 1 mạch hở không phân nhánh.
- Glucozơ có phản ứng tráng bạc, khi tác dụng với nước brom tạo thành axit gluconic, chứng tỏ trong phân tử có nhóm CH=O.
- Glucozơ tác dụng với Cu(OH)2 tạo thành dung dịch màu xanh lam, chứng tỏ phân tử glucozơ có nhiều nhóm OH kề nhau.
- Glucozơ tạo este chứa 5 gốc CH3COO, vậy trong phân tử có 5 nhóm OH.
Suy ra công thức phân tử glucozo dạng mạch hở:
CH2OH–CHOH–CHOH–CHOH–CHOH–CH=O
Hoặc viết gọn là: CH2OH[CHOH]4CHO
2. Dạng mạch vòng
Glucozơ kết tinh tạo ra hai dạng tinh thể có nhiệt độ nóng chảy khác nhau. Các dữ kiện thực nghiệm khác đều cho thấy hai dạng tinh thể đó ứng với hai dạng cấu trúc vòng khác nhau.
Nhóm –OH ở C5 cộng vào nhóm >C=O tạo ra hai dạng vòng 6 cạnh α và β:
1. Dạng mạch hở
Bằng thực nghiệm cho thấy:
- Khử hoàn toàn glucozơ thì thu được hexan. Vậy 6 nguyên tử C của phân tử glucozơ tạo thành 1 mạch hở không phân nhánh.
- Glucozơ có phản ứng tráng bạc, khi tác dụng với nước brom tạo thành axit gluconic, chứng tỏ trong phân tử có nhóm CH=O.
- Glucozơ tác dụng với Cu(OH)2 tạo thành dung dịch màu xanh lam, chứng tỏ phân tử glucozơ có nhiều nhóm OH kề nhau.
- Glucozơ tạo este chứa 5 gốc CH3COO, vậy trong phân tử có 5 nhóm OH.
Suy ra công thức phân tử glucozo dạng mạch hở:
CH2OH–CHOH–CHOH–CHOH–CHOH–CH=O
Hoặc viết gọn là: CH2OH[CHOH]4CHO
2. Dạng mạch vòng
Glucozơ kết tinh tạo ra hai dạng tinh thể có nhiệt độ nóng chảy khác nhau. Các dữ kiện thực nghiệm khác đều cho thấy hai dạng tinh thể đó ứng với hai dạng cấu trúc vòng khác nhau.
Nhóm –OH ở C5 cộng vào nhóm >C=O tạo ra hai dạng vòng 6 cạnh α và β:
 α – glucozơ (≈ 36 %) dạng mạch hở (0,003 %) β – glucozơ (≈ 64 %)
- Nếu nhóm –OH đính với C1 nằm dưới mặt phẳng của vòng 6 cạnh là α-, ngược lại nằm trên mặt phẳng của vòng 6 cạnh là β–
- Nhóm –OH ở vị trí C số 1 được gọi là OH– hemiaxetal
Để đơn giản, công thức cấu tạo của glucozơ có thể được viết như sau:
α – glucozơ (≈ 36 %) dạng mạch hở (0,003 %) β – glucozơ (≈ 64 %)
- Nếu nhóm –OH đính với C1 nằm dưới mặt phẳng của vòng 6 cạnh là α-, ngược lại nằm trên mặt phẳng của vòng 6 cạnh là β–
- Nhóm –OH ở vị trí C số 1 được gọi là OH– hemiaxetal
Để đơn giản, công thức cấu tạo của glucozơ có thể được viết như sau:

III. Tính chất hóa học
Glucozơ có các tính chất của anđehit và ancol đa chức 1. Tính chất của ancol đa chức (poliancol hay poliol) a. Tác dụng với Cu(OH)2 Trong dung dịch, ở nhiệt độ thường glucozơ hòa tan Cu(OH)2 cho dung dịch phức đồng - glucozơ có màu xanh lam: → Phản ứng này chứng minh glucozo có nhiều nhóm OH
b. Phản ứng tạo este
Khi tác dụng với anhiđrit axetic, glucozơ có thể tạo este chứa 5 gốc axetat trong phân tử C6H7O(OCOCH3)5
CH2OH(CHOH)4CHO + 5(CH3CO)2O → CH3COOCH2(CHOOCCH3)4CHO + 5CH3COOH
→ Phản ứng này dùng để chứng minh trong phân tử glucozơ có 5 nhóm OH.
2. Tính chất của anđehit
a. Oxi hóa glucozơ
- Với dung dịch AgNO3 trong NH3, đun nóng (thuốc thử Tollens) cho phản ứng tráng bạc
→ Phản ứng này chứng minh glucozo có nhiều nhóm OH
b. Phản ứng tạo este
Khi tác dụng với anhiđrit axetic, glucozơ có thể tạo este chứa 5 gốc axetat trong phân tử C6H7O(OCOCH3)5
CH2OH(CHOH)4CHO + 5(CH3CO)2O → CH3COOCH2(CHOOCCH3)4CHO + 5CH3COOH
→ Phản ứng này dùng để chứng minh trong phân tử glucozơ có 5 nhóm OH.
2. Tính chất của anđehit
a. Oxi hóa glucozơ
- Với dung dịch AgNO3 trong NH3, đun nóng (thuốc thử Tollens) cho phản ứng tráng bạc
 - Với dung dịch Cu(OH)2 trong NaOH, đun nóng (thuốc thử Felinh) Glucozo khử Cu (II) thành Cu (I) tạo kết tủa đỏ gạch Cu2O.
- Với dung dịch Cu(OH)2 trong NaOH, đun nóng (thuốc thử Felinh) Glucozo khử Cu (II) thành Cu (I) tạo kết tủa đỏ gạch Cu2O.
 - Với dung dịch nước brom:
- Với dung dịch nước brom:
 3. Phản ứng lên men
Khi có enzim xúc tác, glucozơ bị lên men cho ancol etylic và khí cacbonic:
3. Phản ứng lên men
Khi có enzim xúc tác, glucozơ bị lên men cho ancol etylic và khí cacbonic:
 Khi nhóm –OH ở C1 đã chuyển thành nhóm –OCH3, dạng vòng không thể chuyển sang dạng mạch hở được nữa.
Khi nhóm –OH ở C1 đã chuyển thành nhóm –OCH3, dạng vòng không thể chuyển sang dạng mạch hở được nữa.
IV. Điều chế, ứng dụng
1. Điều chế (trong công nghiệp) - Thủy phân tinh bột với xúc tác là HCl loãng hoặc enzim. (C6H10O5)n + nH2O → nC6H12O6 - Thủy phân xenlulozơ với xúc tác HCl đặc:V. Fructozo
Là đồng phân của glucozo. 1. Công thức cấu tạo - Công thức phân tử C6H12O6. - Công thức cấu tạo CH2OH - CHOH - CHOH - CHOH - CO - CH2OH. - Trong dung dịch, fructozơ tồn tại chủ yếu ở dạng β, vòng 5 hoặc 6 cạnh: - Thủy phân mantozo: C12H22O11 + H2O → 2C6H12O6 (glucozơ)
- Thủy phân saccarozo: C12H22O11 + H2O → C6H12O6 (glucozơ) + C6H12O6 (fructozơ)
- Trùng hợp HCHO: 6HCHO → C6H12O6 (Ca(OH)2, to)
2. Ứng dụng
- Trong y học: dùng làm thuốc tăng lực cho người bệnh (dễ hấp thu và cung cấp nhiều năng lượng)
- Trong công nghiệp: dùng để tráng gương, tráng ruột phích (thay cho anđehit vì anđehit độc)
- Thủy phân mantozo: C12H22O11 + H2O → 2C6H12O6 (glucozơ)
- Thủy phân saccarozo: C12H22O11 + H2O → C6H12O6 (glucozơ) + C6H12O6 (fructozơ)
- Trùng hợp HCHO: 6HCHO → C6H12O6 (Ca(OH)2, to)
2. Ứng dụng
- Trong y học: dùng làm thuốc tăng lực cho người bệnh (dễ hấp thu và cung cấp nhiều năng lượng)
- Trong công nghiệp: dùng để tráng gương, tráng ruột phích (thay cho anđehit vì anđehit độc)
V. Fructozo
Là đồng phân của glucozo. 1. Công thức cấu tạo - Công thức phân tử C6H12O6. - Công thức cấu tạo CH2OH - CHOH - CHOH - CHOH - CO - CH2OH. - Trong dung dịch, fructozơ tồn tại chủ yếu ở dạng β, vòng 5 hoặc 6 cạnh:Bài 1 (trang 25 SGK Hóa 12):
Glucozơ và fructozơ: A. Đều tạo được dung dịch màu xanh lam khi tác dụng với Cu(OH)2. B. Đều có chứa nhóm CHO trong phân tử. C. Là hai dạng thù hình của cùng một chất. D. Đều tồn tại chủ yếu dạng mạch hở. Lời giải: Đáp án A.Bài 2 (trang 25 SGK Hóa 12):
Cho các dung dịch: Glucozơ, glixerol, fomandehit, etanol. Thuốc thử nào sau đây có thể phân biệt được cả 4 dung dịch trên ? A. Cu(OH)2. B. Dung dịch AgNO3/NH3. C. Na kim loại. D. Nước brom. Lời giải: Đáp án: A. Cu(OH)2 PTHH:
2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu (xanh lam) + 2H2O
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu (xanh lam) + 2H2O
C5H11O5CHO + 2Cu(OH)2 + NaOH
PTHH:
2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu (xanh lam) + 2H2O
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu (xanh lam) + 2H2O
C5H11O5CHO + 2Cu(OH)2 + NaOH 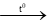 C5H11O5COONa + Cu2O↓ (đỏ gạch) + 3H2O
HCHO + 4Cu(OH)2 + 2NaOH → Na2CO3 + 2Cu2O↓ (đỏ - gạch) + 6H2O
C5H11O5COONa + Cu2O↓ (đỏ gạch) + 3H2O
HCHO + 4Cu(OH)2 + 2NaOH → Na2CO3 + 2Cu2O↓ (đỏ - gạch) + 6H2O
Bài 3 (trang 25 SGK Hóa 12):
Cacbohiđrat là gì? Có mấy loại cacbohiđrat quan trọng? Nêu định nghĩa từng loại và lấy ví dụ minh họa? Lời giải: Cacbohiđrat là những hợp chất hữu cơ tạp chức và đa số chúng có công thức chung là Cn(H2O)m Ví dụ: tinh bột (C6H10O5)n Có nhiều nhóm cacbohiđrat, quan trọng nhất là ba loại sau đây: Monosaccarit là nhóm cacbohiđrat đơn giản nhất, không thể thủy phân được, như : glucozơ và fructozơ. Đisaccarit là nhóm cacbohiđrat mà khi thủy phân mỗi phần tử sinh ra hai phân tử monosaccarit, như : mantozơ. Polisaccarit là nhóm cacbohiđrat phức tạp nhất, khi thủy phân đến cùng mỗi phân tử sinh ra nhiều phân tử monosaccarit, như : tinh bột, ...Bài 4 (trang 25 SGK Hóa 12):
Những thí nghiệm nào chứng minh được cấu tạo phân tử của glucozơ? Lời giải: Những thí nghiệm chứng minh được cấu tạo phân tử glocozơ: Glucozơ có phản ứng tráng bạc và bị oxi hóa bởi nước brom tạo thành axit gluconic chứng tỏ phân tử glucozơ có nhóm –CH=O. Glucozơ tác dụng với Cu(OH)2 cho dung dịch màu xanh lam chứng tỏ phân tử glucozơ có nhiều nhóm -OH ở vị trí kề nhau. Glucozơ tạo este chứa 5 gốc axit CH3COO chứng tỏ phân tử có 5 nhóm –OH. Khử hoàn toàn glucozơ cho hexan, chứng tỏ phân tử glucozơ có 6 nguyên tử C tạo thành một mạch dài không nhánh.Bài 5 (trang 25 SGK Hóa 12):
Trình bày cách nhận biết các hợp chất trong dung dịch của mỗi dãy sau đây bằng phương pháp hóa học: a. Glucozơ, glixerol, etanol, axit axetic. b. Fructozơ, glixerol, etanol. c. Glucozơ, fomandehit, etanol, axit axetic. Lời giải: a. Glucozơ, glixerol, etanol, axit axetic PTHH: 2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu (xanh lam) + 2H2O
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu (xanh lam) + 2H2O
C5H11O5CHO + 2Cu(OH)2 + NaOH
PTHH: 2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu (xanh lam) + 2H2O
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu (xanh lam) + 2H2O
C5H11O5CHO + 2Cu(OH)2 + NaOH  PTHH: 2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu (xanh lam) + 2H2O
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu (xanh lam) + 2H2O
C5H11O5CHO + 2Cu(OH)2 + NaOH
PTHH: 2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu (xanh lam) + 2H2O
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu (xanh lam) + 2H2O
C5H11O5CHO + 2Cu(OH)2 + NaOH  PTHH: 2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu (xanh lam) + 2H2O
HCHO + 4Cu(OH)2 + 2NaOH → Na2CO3 + 2Cu2O↓ (đỏ gạch) + 6H2O
PTHH: 2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu (xanh lam) + 2H2O
HCHO + 4Cu(OH)2 + 2NaOH → Na2CO3 + 2Cu2O↓ (đỏ gạch) + 6H2O
Bài 6 (trang 25 SGK Hóa 12):
Để tráng một chiếc gương soi người ta phải đun nóng một dung dịch chứa 36 gam glucozơ với lượng vừa đủ dung dịch AgNO3/NH3. Tính khối lượng bạc sinh ra bám vào gương soi và khối lượng AgNO3 đã dùng, biết các phản ứng xảy ra hoàn toàn. Lời giải: Số mol glucozơ làChương 1: Este - Lipit
Chương 3: Amin, amino axit và protein
Chương 5: Đại cương về kim loại
- Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
- Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại
- Bài 19: Hợp kim
- Bài 20: Sự ăn mòn kim loại
- Bài 21: Điều chế kim loại
- Bài 22: Luyện tập: Tính chất của kim loại
- Bài 23: Luyện tâp: Điều chế kim loại và sự ăn mòn kim loại
- Bài 24: Thực hành: Tính chất, điều chế kim loại, sự ăn mòn kim loại
Chương 6: Kim loại kiềm, kim loại kiềm thổ, nhôm
- Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
- Bài 26: Kim loại kiềm thổ
- Bài 27: Nhôm và hợp chất của nhôm
- Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
- Bài 29: Luyện tập: Tính chất của nhôm và hợp chất của nhôm
- Bài 30: Thực hành: Tính chất của natri, magie, nhôm và hợp chất của chúng
Chương 7: Sắt và một số kim loại quan trọng
- Bài 31: Sắt
- Bài 32: Hợp chất của sắt
- Bài 33: Hợp kim của sắt
- Bài 34: Crom và hợp chất của crom
- Bài 35: Đồng và hợp chất của đồng
- Bài 36: Sơ lược về niken, kẽm, chì, thiếc
- Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
- Bài 38: Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng
- Bài 39: Thực hành: Tính chất hóa học của sắt, đồng và nhưng hợp chất của sắt, crom
Chương 8: Phân biệt một số chất vô cơ
- Bài 40: Nhận biết một số ion trong dung dịch
- Bài 41: Nhận biết một số chất khí
- Bài 42: Luyện tập: Nhận biết một số chất vô cơ
Chương 9: Hóa học và vấn đề phát triển kinh tế, xã hội, môi trường
Các bài viết liên quan
Các bài viết được xem nhiều nhất
5 tác phẩm trọng tâm ôn thi THPT Quốc gia 2024 môn Ngữ Văn khả năng...
26236 View
Đáp án CHÍNH THỨC đề thi tốt nghiệp THPT 2023 từ Bộ GD&ĐT (Tất cả...
1166 View
Đề thi tốt nghiệp THPT Quốc gia năm 2023 môn Địa lí và gợi ý giải...
1092 View
Đề thi tốt nghiệp THPT Quốc gia năm 2023 môn Giáo dục công dân và gợi...
1080 View
Link tra cứu điểm thi THPT Quốc gia 2023 toàn quốc 63 tỉnh thành. Cách xem...
999 View
Theo dõi Captoc trên




