Bài 30: Thực hành: Tính chất của natri, magie, nhôm và hợp chất của chúng
227 View


Bài 1 (trang 135 SGK Hóa 12):
Viết bản tường trìnhThí nghiệm 1: So sánh khả năng phản úng của Na, Mg, Al với nước.
- Tiến hành TN: Lấy 3 ống nghiệm + Rót nước vào ống nghiệm 1, thêm vài giọt phenolphtalein. Đặt lên giá và cho vào ống nghiệm 1 mẩu Na nhỏ + Rót vào ống nghiệm 2 khoảng 5ml H2O, thêm vài giọt phenolphtalein. Đặt lên giá và cho vào ống nghiệm 1 mẩu Mg nhỏ + Rót vào ống nghiệm 3 khoảng 5ml H2O, thêm vài giọt phenolphtalein. Đặt lên giá và cho vào ống nghiệm 1 mẩu Al đã cạo sạch lớp oxit. Quan sát hiện tượng - Hiện tượng: Khi chưa đun: + Ống 1: Khí thoát ra mạnh, dung dịch thu được có màu hồng. + Ống 2 và ống 3 không có hiện tượng. Giải thích: Ống 1 xảy ra phản ứng. Na + H2O → NaOH +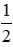 H2.
Khí thoát ra là H2 dung dịch thu được là dung dịch kiềm nên phenolphtalein chuyển màu hồng.
- Ống 2 + 3: Không có hiện tượng do Mg và Al không phản ứng với H2O
Khi đun sôi:
+ Ống 1: Khí thoát ra mạnh, dung dịch thu được có màu hồng.
+ Ống 2: Dung dịch thu được có màu hồng nhạt.
+ Ống 3: Không có hiện tượng.
Giải thích: Ống 2: Mg tác dụng với nước ở nhiệt độ cao tạo ra dung dịch bazơ yếu nên dung dịch có màu hồng nhạt.
Ống 3: Lớp bảo vệ Al(OH)3 ngăn không cho Al tác dụng với nước ở mọi điều kiện
Kết luận: Khả năng phản ứng với nước Na > Mg > Al.
H2.
Khí thoát ra là H2 dung dịch thu được là dung dịch kiềm nên phenolphtalein chuyển màu hồng.
- Ống 2 + 3: Không có hiện tượng do Mg và Al không phản ứng với H2O
Khi đun sôi:
+ Ống 1: Khí thoát ra mạnh, dung dịch thu được có màu hồng.
+ Ống 2: Dung dịch thu được có màu hồng nhạt.
+ Ống 3: Không có hiện tượng.
Giải thích: Ống 2: Mg tác dụng với nước ở nhiệt độ cao tạo ra dung dịch bazơ yếu nên dung dịch có màu hồng nhạt.
Ống 3: Lớp bảo vệ Al(OH)3 ngăn không cho Al tác dụng với nước ở mọi điều kiện
Kết luận: Khả năng phản ứng với nước Na > Mg > Al.
Thí nghiệm 2: Nhôm tác dụng với dung dịch kiềm.
- Tiến hành TN: + Rót vào ống nghiệm 2-3 ml dd NaOH loãng, thêm vào đó 1 mẩu nhôm. + Đun nóng nhẹ ống nghiệm và quan sát hiện tượng. - Hiện tượng: Có bọt khí thoát ra. - Giải thích: Khi cho Al vào dung dịch NaOH thì lớp Al2O3 trên bề mặt Al bị bào mòn. Al2O3 + 2NaOH → 2NaAlO2 + H2O. Al mất lớp bảo vệ Al2O3 tác dụng với nước: 2Al + 6H2O → 2Al(OH)3 + 3H2. Al(OH)3 sinh ra lại tan trong dung dịch kiềm Al(OH)3 + NaOH → NaAlO2 + 2H2O. 2 phản ứng xảy ra xen kẽ nhau đến khi Al tan hoàn toàn.Thí nghiệm 3: Tính chất lưỡng tính của Al(OH)3.
- Tiến hành TN: + Rót vào 2 ống nghiệm, mỗi khoảng 3ml dd AlCl3, sau đó nhỏ dd NH3 dư vào 2 ống nghiệm + Tiếp tục nhỏ dd H2SO4 vào ống 1, lắc nhẹ. Nhỏ dd NaOH vào ống 2, lắc nhẹ Quan sát hiện tượng - Hiện tượng: Nhỏ NH3 vào cả 2 ống đều xuất hiện kết tủa trắng Sau khi thêm H2SO4 và NaOH vào 2 ống thấy kết tủa trong cả 2 ống đều tan. - Giải thích Kết tủa trắng là Al(OH)3 tạo thành sau phản ứng: AlCl3 + 3H2O + 3NH3 → Al(OH)3 + 3NH4Cl. Kết tủa tan là do Al(OH)3 phản ứng với axit và kiềm tạo ra muối tan: Al(OH)3 + NaOH → NaAlO2 + 2H2O. 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O Kết luận : Al(OH)3 là hiđroxit lưỡng tính.Chương 1: Este - Lipit
Chương 3: Amin, amino axit và protein
Chương 5: Đại cương về kim loại
- Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
- Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại
- Bài 19: Hợp kim
- Bài 20: Sự ăn mòn kim loại
- Bài 21: Điều chế kim loại
- Bài 22: Luyện tập: Tính chất của kim loại
- Bài 23: Luyện tâp: Điều chế kim loại và sự ăn mòn kim loại
- Bài 24: Thực hành: Tính chất, điều chế kim loại, sự ăn mòn kim loại
Chương 6: Kim loại kiềm, kim loại kiềm thổ, nhôm
- Bài 25: Kim loại kiềm và hợp chất quan trọng của kim loại kiềm
- Bài 26: Kim loại kiềm thổ
- Bài 27: Nhôm và hợp chất của nhôm
- Bài 28: Luyện tập: Tính chất của kim loại kiềm, kim loại kiềm thổ và hợp chất của chúng
- Bài 29: Luyện tập: Tính chất của nhôm và hợp chất của nhôm
- Bài 30: Thực hành: Tính chất của natri, magie, nhôm và hợp chất của chúng
Chương 7: Sắt và một số kim loại quan trọng
- Bài 31: Sắt
- Bài 32: Hợp chất của sắt
- Bài 33: Hợp kim của sắt
- Bài 34: Crom và hợp chất của crom
- Bài 35: Đồng và hợp chất của đồng
- Bài 36: Sơ lược về niken, kẽm, chì, thiếc
- Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
- Bài 38: Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng
- Bài 39: Thực hành: Tính chất hóa học của sắt, đồng và nhưng hợp chất của sắt, crom
Chương 8: Phân biệt một số chất vô cơ
- Bài 40: Nhận biết một số ion trong dung dịch
- Bài 41: Nhận biết một số chất khí
- Bài 42: Luyện tập: Nhận biết một số chất vô cơ
Chương 9: Hóa học và vấn đề phát triển kinh tế, xã hội, môi trường
Các bài viết liên quan
Các bài viết được xem nhiều nhất
5 tác phẩm trọng tâm ôn thi THPT Quốc gia 2024 môn Ngữ Văn khả năng...
26236 View
Đáp án CHÍNH THỨC đề thi tốt nghiệp THPT 2023 từ Bộ GD&ĐT (Tất cả...
1166 View
Đề thi tốt nghiệp THPT Quốc gia năm 2023 môn Địa lí và gợi ý giải...
1092 View
Đề thi tốt nghiệp THPT Quốc gia năm 2023 môn Giáo dục công dân và gợi...
1080 View
Link tra cứu điểm thi THPT Quốc gia 2023 toàn quốc 63 tỉnh thành. Cách xem...
999 View
Theo dõi Captoc trên




